利用Qiagen IPA 建立早期復發肝細胞癌生態系統的單細胞概況
Ingenuity Pathway Analysis (IPA)經過20多年發展,百位博士透過閱讀文獻後,去蕪存菁彙編入資料庫,收錄了超過1230萬條生物學相關證據和13萬個公共資料集,並且每週更新文獻資料庫。 透過IPA可以快速了解腫瘤發生影響的訊號路徑和生物學過程,發現腫瘤發生的關鍵調控因子,建構分子間的調控網路,幫助您全面地理解腫瘤發生的分子機理,協助開發標靶治療藥物。
簡介
肝癌,全球第四大致命癌症,以肝細胞癌(HCC)佔75%至85%的病例,手術切除是最有效的治療方式,具有潛在的治癒可能性。然而,腫瘤高復發率(手術後5年達50%至70%)讓病患的生存率無法提高。在所有的HCC復發病例中,術後2年內的早期復發就佔了七成,這不僅讓肝癌難以治療,影響預後。對腫瘤復發的深入探討,可增進我們對與腫瘤發展相關的機制的理解,並有助於發現更有效的找出HCC治療策略。腫瘤是由不同細胞間複雜互動所組成,包括惡性、免疫和基質細胞。免疫檢查點阻斷(ICBs)在多種癌症中表現出臨床效益,然而,在HCC中反應率較低。腫瘤微環境可能影響ICBs治療效果,因此深入研究HCC細胞生態系統可提供微觀視野,助於設計更有效的治療策略,尤其針對復發患者。單細胞RNA序列(scRNA-seq)是研究腫瘤微環境的強大工具,但對早期復發HCC的單細胞生態系統和免疫表型的全面描述仍然不足。
研究方法
本篇納入經由中國復旦大學中山醫院病理學診斷,共69名患有肝細胞癌(HCC)的患者。發現組(Discovery cohort)為18名接受治療的原發或早期復發的HCC患者,收集了成對的新鮮腫瘤和相鄰正常組織。第1組驗證族群為4名患者的成對原發和復發腫瘤樣本的新鮮細胞液;第2組驗證族群為47名患者的成對原發和早期復發的福馬林固定石蠟包埋(FFPE)組織。使用10x Genomics Chromium Single Cell 50 Library Construction Kit和Chromium Single Cell V(D)J Enrichment Kit,進行單細胞或單核轉錄組和TCR VDJ library的構建並在BGISEQ500定序儀上進行定序。單細胞分選、反轉錄、增幅和定序,使用了MIRALCS和SMART-seq2方法,以獲取全長單細胞RNA序列。
路徑分析
通過路徑分析,作者探討了原發(PT)和復發(RT)腫瘤細胞之間的細胞功能差異。利用基因富集分析(GSEA)識別的差異表達基因(DEGs),深入研究了與CD8 T細胞軌跡相關的Hallmark基因集和Reactome途徑。此外,對PT和RT中CD8細胞之間的差異表達基因(DEGs)亦使用Ingenuity Pathway Analysis(IPA)全面描述了細胞的生物學功能。IPA核心分析突顯了與各種細胞類型中差異表達基因相關的典型途徑、疾病、功能、上游調節因子和基因網路。這種綜合型分析可以深入了解PT和RT惡性細胞的分子作用機制,有助於更深入了解腫瘤進展及潛在標靶治療。
結果
原發性和早期復發肝癌腫瘤生態系統的單細胞RNA序列分析
在發現組中,對原發HCC和早期復發HCC的細胞群體進行了全外顯子定序(WES)分析,確認早期復發的HCC是再發性而不是新發性腫瘤。基因突變、單核苷酸變異(SNVs) 、插入缺失(INDELs)的系統樹分析顯示,早期復發HCC患者的腫瘤和相應的原發HCC樣本在進化上是有因果關係的。
由於患者免疫浸潤水準的差異,研究使用流式細胞儀(FACS)分離CD45+和CD45–細胞,並進行scRNA-seq分析。分析結果發現了24個細胞群,包括免疫細胞和非免疫細胞。非免疫細胞主要包括內皮細胞、肝星狀細胞、表皮細胞和HCC惡性細胞。免疫細胞包涵骨髓源性細胞、T細胞、B細胞、漿细胞和自然殺手細胞。
在免疫細胞中,作者針對骨髓源性細胞和T細胞/NK細胞進行無監督分群(unsupervised clustering)。骨髓源性細胞分為巨噬細胞、單核細胞和樹突細胞,其中巨噬細胞主要表現CD163和CD68,且亞群在不同患者中有差異。單核細胞分為兩個亞群,具有不同的基因特徵。整體而言,巨噬細胞在腫瘤中明顯豐富,呈現M2型標誌。這些發現揭示了早期復發HCC中獨特的免疫生態系統。
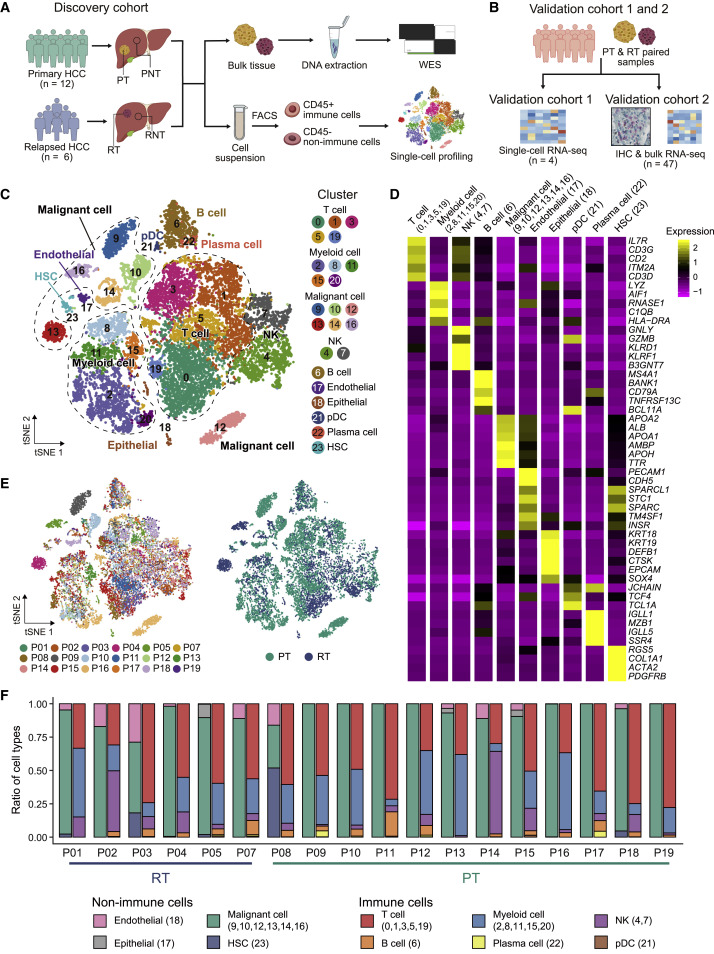
圖1. 利用單細胞RNA序列(ScRNA-seq)描繪原發和復發HCC腫瘤環境
(A和B)實驗設計的示意圖。在(A)中顯示了發現組,而在(B)中顯示了驗證組1和2。每個組中患者的數量(n)在圖中有提供。
(C)t-SNE圖,顯示了HCC生態系統中不同細胞類型的標註和顏色編碼。
(D)熱圖顯示了指定細胞類型中標誌基因的表達情況。頂部的條形標籤標明了對應特定細胞類型的分類,方括號中的數字對應於(C)中的分類編號。
(E)t-SNE圖,根據顏色顯示細胞的來源,左側是患者的來源(左),右側是原發(PT)或復發(RT)的來源(右)。
(F)直方圖顯示了每位分析患者腫瘤組織中細胞比例。非免疫細胞和免疫細胞分別顯示在不同的直方圖中。
CD8+ T細胞在原發性和早期復發的肝細胞癌(HCC)中共享相同的轉變軌跡,但存在於不同的狀態。
CD8+ T細胞在原發性和早期復發的肝細胞癌(HCC)中經歷相同的轉變軌跡,但在不同的免疫和轉錄狀態中存在差異。透過Monocle進行狀態軌跡推斷,轉錄變化分為4階段,其中第1階段的細胞主要與脂質代謝和TGF-β受體信號相關,而第3階段的細胞則表現經典的細胞毒性基因。在CD8+ T細胞狀態轉變過程中,免疫檢查點的表達異質性,顯示對於HCC患者的治療應採用特定的標靶策略。新發個案與早期復發樣本中的CD8+ T細胞表現相同的轉變軌跡,但免疫和轉錄狀態差異明顯,強調原發性和復發性HCC的治療需考慮不同的免疫療法策略。
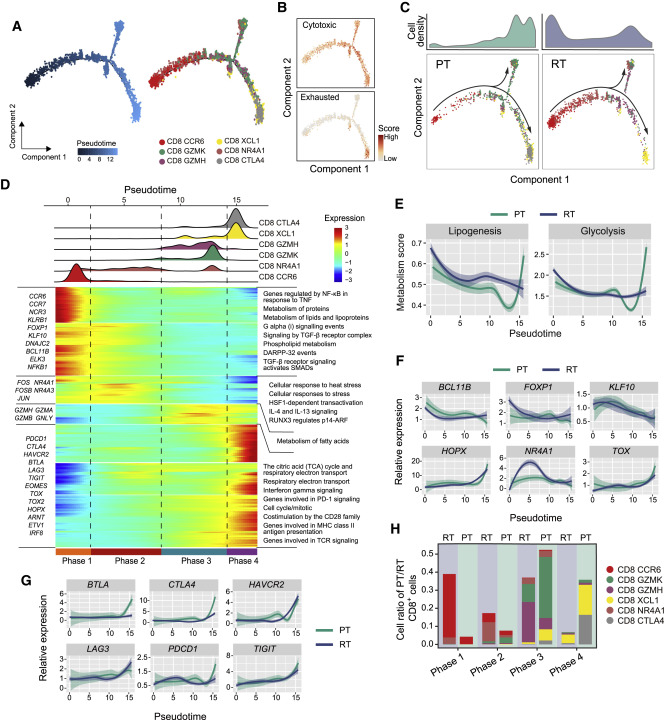
圖四
(A)來自PT和RT樣本的CD8+ T細胞的偽時間排序分析。 T細胞亞型以顏色標記。
(B)2D偽時間圖顯示來自PT和RT樣本的CD8+ T細胞中細胞毒性(上)或耗竭信號(下)的動態。
(C)2D偽時間排序的CD8+ T細胞圖,來自PT(左)和RT(右)樣本。細胞密度分布依照狀態顯示在圖的頂部。
(D)熱圖顯示基因表達在偽時間軸上的動態變化(下)。在轉變過程中CD8亞型的分布(分為4個階段)以及偽時間。亞型以顏色標記(上)。
(E)2D圖顯示與脂質生成和糖酵解相關的基因在PT(綠色)和RT(藍色)樣本中的表達分數,X軸為 偽時間軸。
(F和G)2D圖顯示T細胞轉變過程中轉錄因子(F)和檢查點基因(G)的動態表達。
(H)直方圖顯示CD8+ T細胞在RT和PT樣本中的細胞分佈。 CD8亞型以顏色標記。
在早期復發的肝細胞癌(HCC)中,CD8+ T 細胞呈現一種先天表型(innate-like phenotype)。
與原發性腫瘤(PT)樣本相比,這些復發(RT)樣本中的細胞表現出較低的耗竭標誌和檢查點基因表達。基因差異表達分析顯示較低的抑制性信號,並且Ingenuity Pathway Analysis(IPA)顯示,RT 中的 CD8+ T 細胞以 OX40信號通路和 T 細胞訊號路徑耗竭信號通路被抑制,顯示這些細胞處於活化程度較低但並未耗盡的狀態,確定PDGF-BB為主要調節因子。RT中的CD8+ T 細胞表現出增強的氧化壓力反應,氧化磷酸化基因低度表現以及潛在的代謝異常。KLRB1和IL7R的高度表現表明一種固有樣態和內存 T 細胞表型。RT中富集的CD8+CD161+ T 細胞表現較低的細胞毒性,與更高的復發率相關。轉錄體分析支持KLRB1高CD8 T 細胞作為HCC復發和原發病例中不良預後的指標。總的來說,RT中的CD8+ T 細胞呈現出一種與PT中觀察到的疲憊狀態不同的先天表型,對於HCC的預後和腫瘤進展具有重要意義。
IPA 重現本篇文獻的成果
本篇研究中的Table S4, 針對CD8+ T cell 在RT 以及PT 中差異表現量的基因,我們上傳至IPA中重現本篇的發現。結果如下圖 A呈現,這七個路徑分別為Oxidative Phosphorylation,Sirtuin Signaling Pathway,NRF2-mediated Oxidative Stress Response,T Cell Receptor Signaling,CD28 Signaling in T Helper Cells,OX40 Signaling Pathway與Calcium-induced T Lymphocyte Apoptosis。在這些基因中最富集在Oxidative Phosphorylation,且P-value 最為顯著。此外,若將這些路徑加以分組,如圖B所示
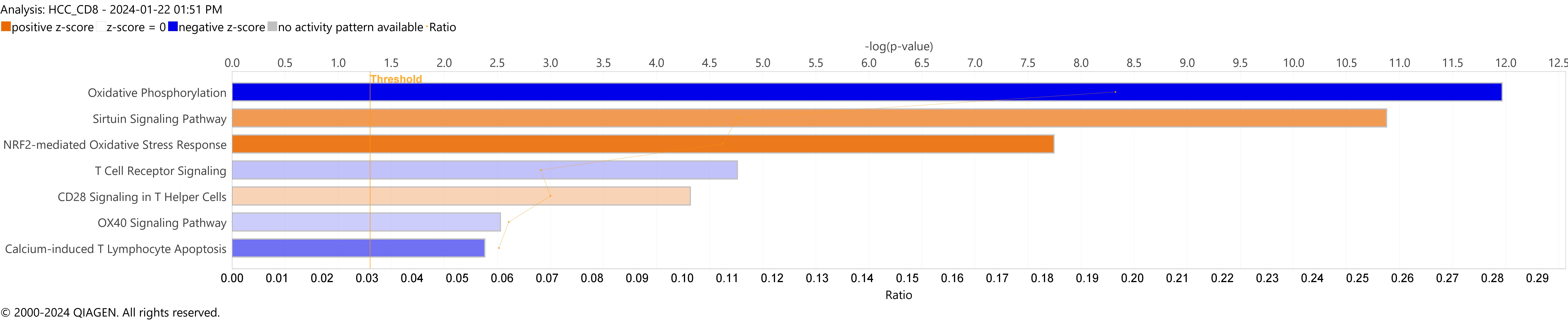
圖 A Bar chart 展現文獻中七個路徑的富集情形與P value
圖B顯示該七個路徑分類狀況,其中最顯著的分類為Generation of Precursor Metabolites and Energy。
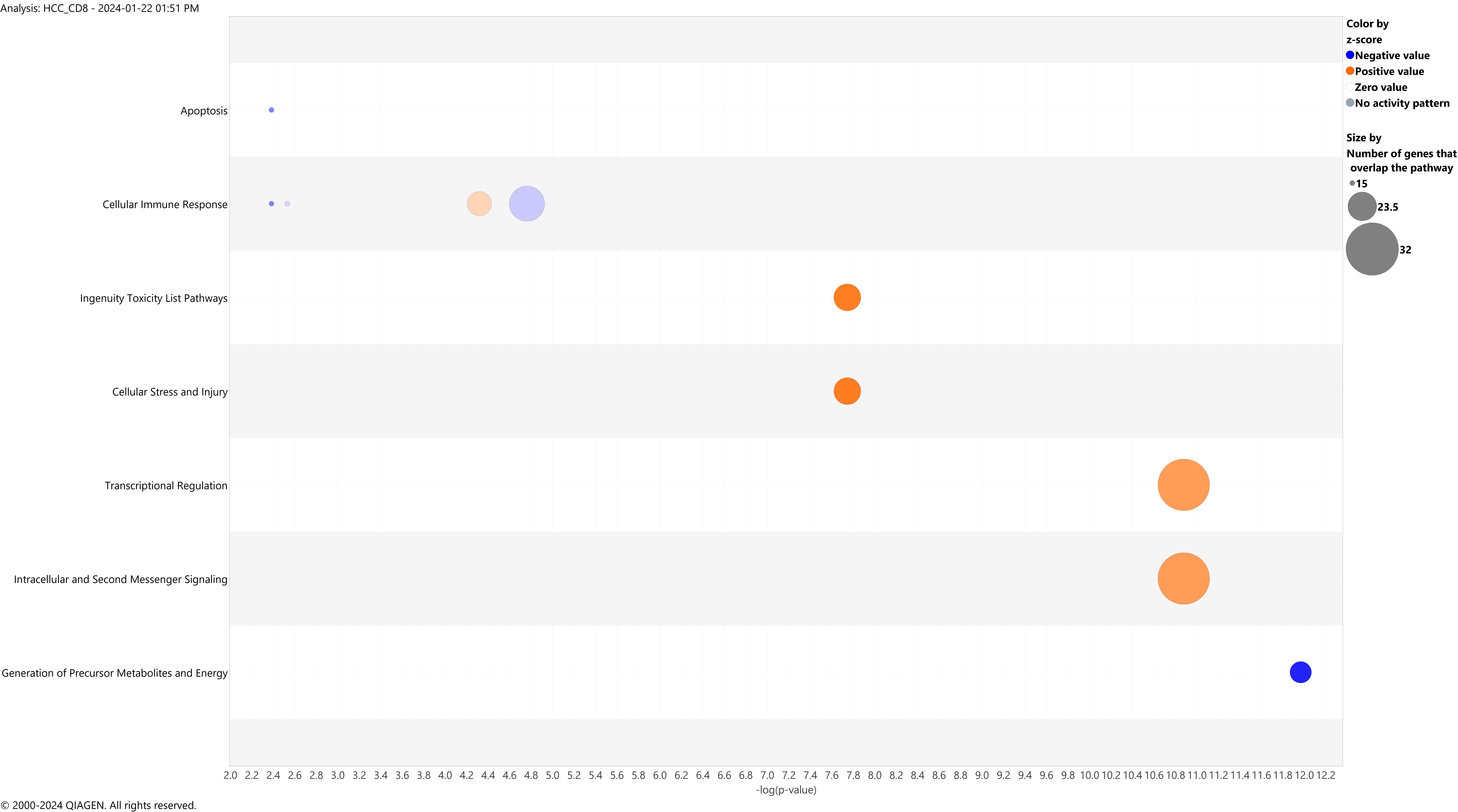
圖 B 泡泡圖 展現文獻中七個路徑的分類與包含基因的數目,泡泡大小與包含基因有關。X軸為P value。Y 軸為路徑的分類情形。
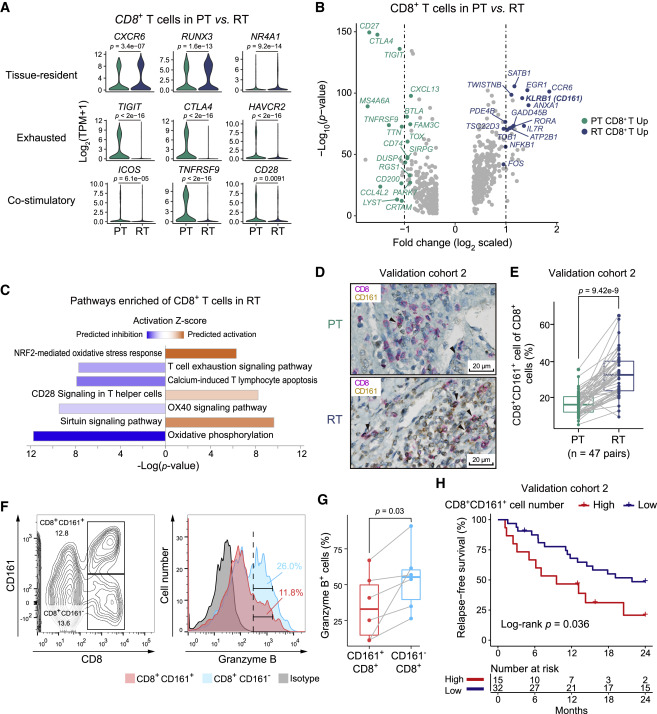
圖五 CD8 + T 細胞在復發性 HCC 中呈現先天性表型
(A)小提琴圖顯示PT(綠色)和RT(藍色)樣本中CD8+ T 細胞中組織常駐、耗竭和共刺激基因的表達。p值由Student's t檢驗計算。(B)火山圖顯示PT(綠點)和RT CD8+ T 細胞(藍點)之間的差異表達基因。圖中的點為最顯著基因。
(C)雙向條形圖顯示IPA中CD8+ T 細胞在RT中所特別顯著的活化和抑制途徑。
(D)使用CD8和CD161抗體的IHC染色結果,顯示來自第2組驗證群體的PT和RT樣本中CD8+CD161+ T 細胞的浸潤情形。刻度尺寸為20 μm(E)箱形圖顯示47對匹配的PT和RT樣本中CD8+CD161+ T 細胞的比例,基於IHC結果。統計分析使用配對的Wilcoxon檢驗。
(F)雙向FACs圖顯示HCC腫瘤組織中的CD8+CD161+和CD8+CD161- T 細胞(左圖)。這些細胞中granzyme B表達的分佈以累積的直方圖表示(右圖)。圖中指示了細胞的比例。
(G)箱形圖顯示CD8+CD161-和CD8+CD161+ T 細胞中GZMB+細胞的比例。p值來自配對的Wilcoxon檢驗。
(H)Kaplan-Meier分析顯示以CD8+CD161+ T 細胞數量高與低的患者復發無病存活率的關係。圖中指示了患者數量和風險分類。顯著性使用log-rank檢驗計算。N代表患者數。
結論
肝細胞癌(HCC)具有高復發和五年內低生存率的特性,在復發HCC中進行單細胞分析可能有助於設計有效的抗癌治療,包括免疫治療。作者對來自18例原發性或早期復發HCC的約17,000個細胞的轉錄組進行了分析。與原發性腫瘤相比,早期復發中的調節性T細胞水平降低,樹突狀細胞(DCs)水平增加,浸潤的CD8+ T細胞水平增加,這在兩個驗證族群中都觀察到。顯著的是,復發腫瘤中的CD8+ T細胞過度表達KLRB1(CD161),並且透過Ingenuity pathway analysis(IPA)分析,發現CD8+ T細胞在肝癌復發後受影響的途徑,顯示OX40信號通路和T細胞耗竭信號通路被抑制。OX40是T細胞活化的標誌,抑制OX40通路代表在復發的肝癌患者中CD8+ T細胞未被活化,而抑制T細胞耗竭通路則說明CD8+ T細胞在復發患者中未處於衰竭狀態。這表明CD8+ T細胞在肝癌復發患者中呈現出先天表型的功能障礙狀態,從而損害抗腫瘤免疫,導致肝癌復發。呈現先天性表型的低細胞毒性狀態,與在原發性HCC中觀察到的典型耗竭狀態不同。並且利用這些細胞惡化的預後。基因差異表達和互動分析揭示了在復發腫瘤細胞中可能存在的免疫逃避機制,該機制抑制了DC抗原呈現並招募具有先天表型的CD8+ T細胞。我們對HCC生態系統的全面了解提供了更深入的洞察與腫瘤復發相關的免疫逃避機制。
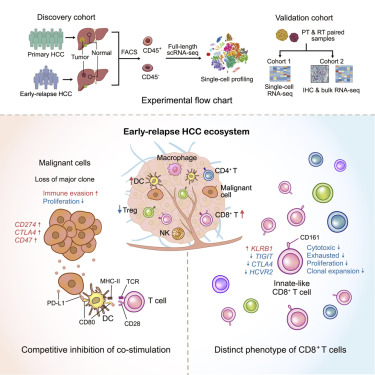
圖 圖形化摘要揭示了早期復發的肝細胞癌的細胞生態系
參考文獻
Sun et al. Cell. 2021 Jan 21;184(2):404-421.e16.

